基础研究与临床研究的有机融合——超声科任杰教授团队与纳米医学中心帅心涛教授团队联合研发淋巴靶向纳米药物用于激活完整的癌症-免疫循环
近日,新葡亰8883ent超声科任杰教授团队与纳米医学中心帅心涛教授团队联合,在抗肿瘤免疫治疗中取得新的进展。研究成果以“Dual-Responsive Nanomedicine Activates Programmed Antitumor Immunity through Targeting Lymphatic System”为题,发表于国际顶级期刊ACS Nano(最新影响因子17.1)。该研究的第一作者为超声科博士后肖洪,通讯作者为新葡亰8883ent的任杰教授和帅心涛教授。这一研究是纳米中心基础研究团队与临床学科超声团队在交叉学科领域的又一合作研究,为抗肿瘤免疫治疗提供了新的思路和方法。
本研究基于癌症-免疫循环的理论框架,研发了一种双响应性纳米药物。这种药物具有独特的响应性药物释放机制,能够程序性地激活抗肿瘤免疫应答。通过这一机制,成功地建立了一个完整的癌症-免疫循环正反馈回路,该回路涵盖了淋巴结内的免疫激活、T细胞介导的靶向药物输送、免疫检查点阻断(ICB)治疗,以及肿瘤细胞焦亡诱导的免疫原性细胞死亡(ICD)。在乳腺肿瘤模型上的实验结果显示,该纳米药物展现出了显著的抗肿瘤疗效。
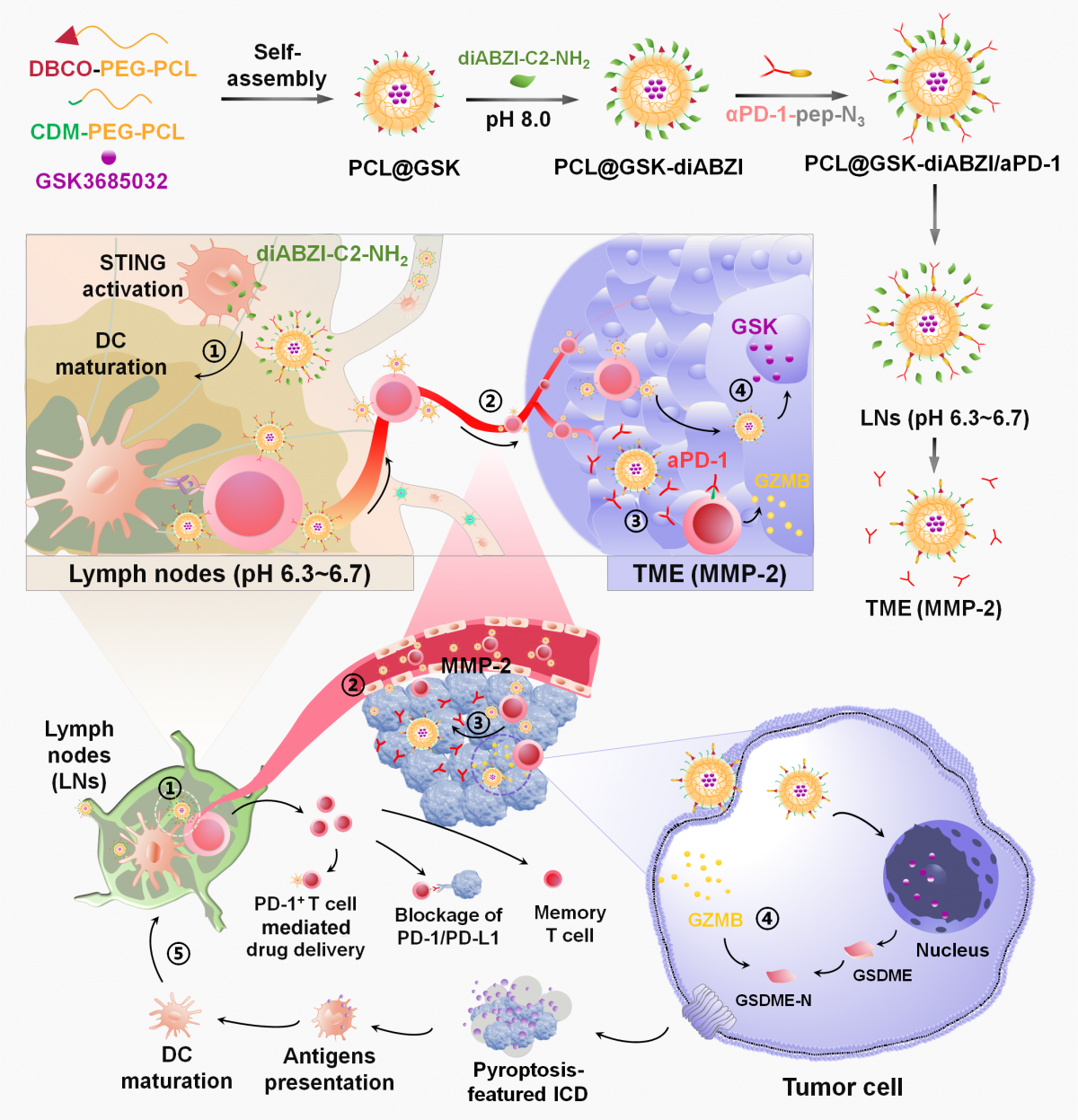
图1、双响应纳米药物靶向淋巴系统程序性激活抗肿瘤免疫示意图。①在淋巴结内的免疫激活,②T细胞介导的药物递送,③酶响应性aPD-1释放及免疫检查点阻断(ICB),④肿瘤细胞焦亡,⑤免疫原性细胞死亡(ICD)增强树突细胞的成熟,从而形成癌症-免疫循环正反馈回路。
虽然免疫治疗在某些类型的癌症中取得了显著的临床成果,但在大多数实体瘤中,其带来的生存获益仍然有限,患者的反应率也普遍较低,仅在10-30%之间。有效的抗肿瘤免疫治疗的关键在于启动一个完整的癌症-免疫循环,该循环包括癌症抗原的释放与呈递、T细胞的启动与激活、T细胞向肿瘤组织的迁移与浸润,以及T细胞对癌细胞的最终识别与清除。然而,令人遗憾的是,免疫抑制性的肿瘤微环境(TME)经常打断这一循环的顺利进行,从而影响免疫治疗的效果。无论是免疫检查点阻断(ICB)治疗、过继细胞转移治疗、细胞因子免疫治疗,还是多药物联合治疗,在肿瘤微环境的影响下都可能无法充分发挥其效用。因此,我们当前急需探索新的策略,以激活完整的癌症-免疫循环,进而提升抗肿瘤免疫效应。
在癌症-免疫循环中,癌症抗原向T细胞的呈递和T细胞的激活这两个核心环节主要发生在淋巴结(LNs)内。免疫细胞在人体内的分布并不均匀,它们大量聚集在淋巴结中。作为免疫系统的重要基石,淋巴结为通过淋巴系统给药提供了一条直接的免疫激活路径。目前,疫苗就是通过靶向淋巴系统成功应用的药物之一。鉴于淋巴结内的免疫激活在抗肿瘤免疫治疗中的至关重要性,我们有望通过采用靶向淋巴结的药物递送策略,来提升抗原呈递细胞(APCs)的抗原呈递效能,从而进一步促进T细胞的激活,最终增强抗肿瘤免疫反应的效果。
实体瘤内的高度免疫抑制性微环境(TME)对淋巴结(LNs)内的抗肿瘤免疫激活构成了严峻挑战。在此环境中,抗原呈递细胞常展现不成熟及免疫抑制状态,导致效应T细胞激活不足且募集受阻。诸多研究报道,诱导肿瘤免疫原性细胞死亡(ICD)是重塑免疫抑制性TME并增强抗肿瘤免疫反应的有效策略。而焦亡作为一种炎症型程序性细胞死亡方式,可以诱导强烈ICD,有可能最大化ICB响应率。然而,焦亡效应蛋白GSDM在大多数癌症类型中表达下调,从而限制了焦亡的触发及对抗肿瘤免疫的增效。比如在乳腺癌中,启动子DNA甲基化导致的GSDME表观遗传失活,从而导致患者更差的生存率和转移风险性大幅增加。通过抑制DNA甲基化上调GSDM表达,可能增强焦亡以获得有效的抗肿瘤免疫。在这种情况下,如何实现不同的治疗药物特异性的靶向递送,协同作用淋巴细胞和肿瘤细胞,是一个巨大的挑战。
为此,我们提出了一种策略来增强癌症-免疫循环(图1),该策略包含淋巴结中的免疫激活、T细胞介导的药物递送、以焦亡为特征的ICD和ICB治疗等程序。我们构建了一种pH和酶双重响应的纳米药物,能在淋巴结和肿瘤组织中顺序释放药物,以实现程序化的抗肿瘤免疫激活。这种纳米药物首先能在淋巴结酸性环境中(pH 6.3~6.7)释放STING激动剂diABZI-C2-NH2来激活DCs和T细胞。随后,携带PD-1抗体(aPD-1)的纳米药物与活化的T细胞(PD-1+ T细胞)结合,利用这些细胞的肿瘤归巢能力实现高效的肿瘤靶向药物递送。在肿瘤组织中,基质金属蛋白酶-2(MMP-2)切割酶敏感肽(pep)以释放纳米药物,同时将aPD-1留在T细胞上进行ICB治疗。此外,纳米药物还可递送DNA甲基化抑制剂GSK-3484862(GSK)到肿瘤细胞中,以抑制其增殖并上调GSDME,诱导肿瘤细胞焦亡产生ICD。通过精心设计的淋巴靶向策略和响应性机制,成功激活了完整的癌症-免疫循环,从而带来了显著的抗肿瘤治疗效果。
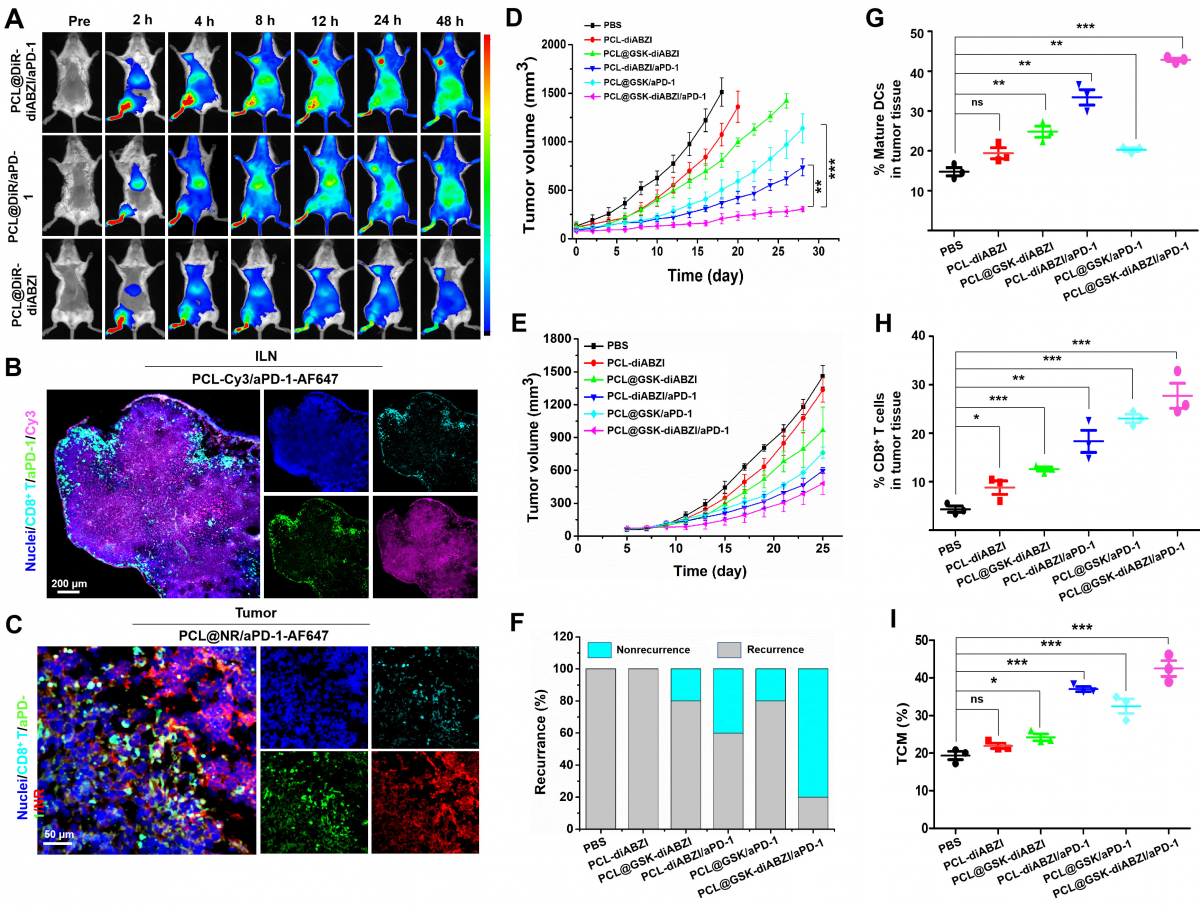
图2、(A)纳米药物的肿瘤聚集效应。ILN:腹股沟淋巴结。(B)LNs中pH响应性药物释放和(C)肿瘤组织中MMP-2酶响应性aPD-1释放。(D)接受不同纳米药物治疗的小鼠平均肿瘤生长曲线。(E)不同纳米药物治疗小鼠肿瘤复发的统计分析和(F)继发性肿瘤生长曲线。流式细胞检测显示了小鼠肿瘤组织中(G)成熟DC细胞、(H)CD8+ T细胞和(I)血液中央记忆T细胞(TCM)的占比。
新葡亰8883ent超声科获建国家临床重点专科项目,任杰教授作为超声学科带头人,带领团队长期致力于浅表肿瘤和肝脏疾病的精准诊疗。新葡亰8883ent纳米医学中心,作为医院倾力打造的基础研究高地,在帅心涛教授的引领下,与多个临床团队实现深度的交流与融合。本研究紧扣肿瘤免疫治疗的前沿话题,充分发挥了纳米药物在多药联合传递及响应性释放方面的独特优势,成功地激活了完整的癌症-免疫循环,从而取得了显著的抗肿瘤成果。特别针对乳腺癌免疫治疗反应率较低的实际临床问题,通过创新的纳米药物设计,紧密围绕临床需求进行研究。这一研究不仅强化了基础研究与临床应用之间的紧密联系,更为医院的跨学科研究注入了新的活力,推动了其向更高层次的发展。
文章链接:https://doi.org/10.1021/acsnano.3c11464







